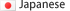融合するミトコンドリアを試験管内でつくる
ミトコンドリアの内膜融合の試験管内での再構成
研究の背景
ミトコンドリアは外膜と内膜の二つの膜に囲まれた細胞内小器官であり、酸素呼吸により生命活動に必要なエネルギーを作り出しながら、同時に細胞死の制御にも中心的な働きをしており、細胞の「生と死」の両面で重要な役割を持っています。細胞の中では、ミトコンドリアは細長く枝分かれした形態を持ち、融合と分裂を頻繁に繰り返しています。このミトコンドリアの形態変化は、神経変性疾患や心疾患を含む様々な病気に関与していることが明らかになりつつあります。これまでの研究から、ミトコンドリアの融合には、膜に存在するGTP加水分解酵素(GTPase)や脂質などの様々な生体高分子が関与していますが、その詳しい仕組みはよく分かっていませんでした。
研究の内容
今回、ミトコンドリアの融合の仕組みを明らかにするために、酵素と脂質から人工脂質膜小胞を作成し、試験管の中で融合反応を再現しました。
視覚障害となる遺伝病の原因遺伝子産物として同定されたOPA1は、ミトコンドリア内膜の融合に働くGTPaseです。しかし、OPA1は複雑な構造を持つ高分子量タンパク質であるため、これまで膜融合の解析に適した高純度のOPA1を得ることが困難でした。今回、北大の前仲教授らが開発したカイコの幼虫を利用する手法を利用することで、大量のOPA1を得ることに成功し、試験管内でミトコンドリアの膜融合反応を再現することが可能となりました(図1)。
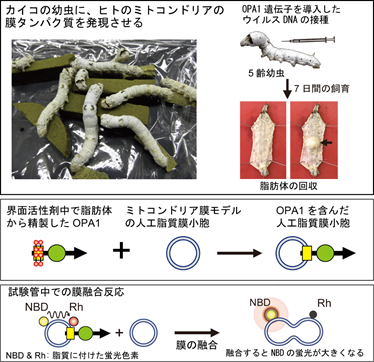
図1、OPA1の大量発現・精製系、試験管内での膜融合反応系の構築
この反応を詳細に解析したところ、これまでに知られた膜融合反応と全く異なる特性を見出しました(図2)。
(1) 一方の膜にだけOPA1があれば、膜融合がおきることがわかりました。
(2)ミトコンドリアにのみ存在する、カルジオリピンというリン脂質がOPA1のパートナーとして融合に働くことがわかりました。
(3) OPA1とカルジオリピンの変動により、機能の低いミトコンドリアが優先的に選別されることわかりました(図3)。その後オートファジーにより分解されることで、健康なミトコンドリアのみが維持されると考えられます。
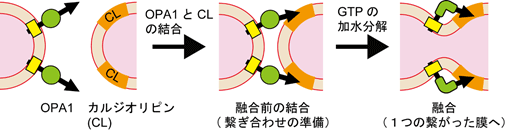
図2、OPA1によるミトコンドリア融合のモデル
① 一方の膜のOPA1がもう一方の膜の脂質カルジオリピン(CL)と特異的に結合する(融合前の結合)、② OPA1の酵素活性でGTPを分解して高エネルギーが使われる、③ 2つの膜が融合して1つの繋がった膜になる
図3、機能不全が生じたミトコンドリアの選択的な排除
OPA1とCLの両方に機能不全が生じたミトコンドリアは、他のミトコンドリアと融合できないので、選択的に排除されて、最終的にはオートファジーによって分解される。
意義と今後の展開
これまでに知られていた小胞輸送における膜融合(Schekman、Rothmanら、2013年ノーベル生理学医学賞)では、両方の膜にタンパク質が必要で、それらが融合前に結合することが常識だと考えられてきました。しかし今回、ミトコンドリア内膜は独特な一方向性の膜融合をすることがわかりました(図2)。ミトコンドリアは、病気の組織の中では、また老化に伴って、障害が蓄積することが知られていますが、今回機能不全となったミトコンドリアを優先的にオートファジー分解に導くための機構が明らかになりました。
今後、OPA1とカルジオリピンに着目して研究を進めることで、体の中のミトコンドリアを健康に維持する新しい手法の開発が期待されます。
“Molecular basis of selective mitochondrial fusion by heterotypic action between OPA1 and cardiolipin.”
(OPA1とカルジオリピンの一方向性の働きによる、選択的なミトコンドリア融合の分子基盤の解明)
Tadato Ban, Takaya Ishihara, Hiroto Kohno, Shotaro Saita, Ayaka Ichimura, Katsumi Maenaka, Toshihiko Oka, Katsuyoshi Mihara and Naotada Ishihara
Nature Cell Biology 19: 856-863 (2017 ) リンク
無断転載を禁じます